Objetivos de Aprendizaje
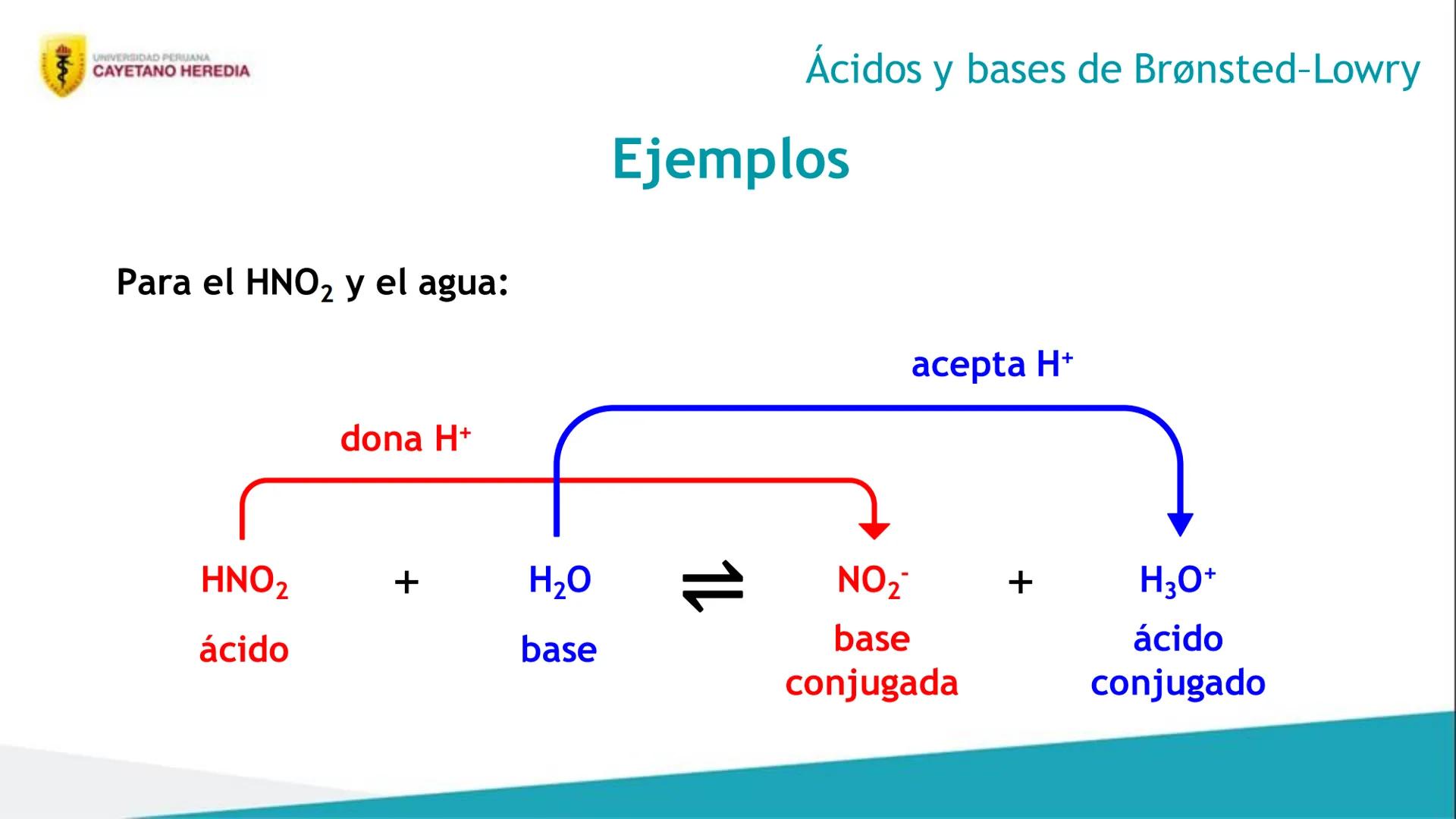
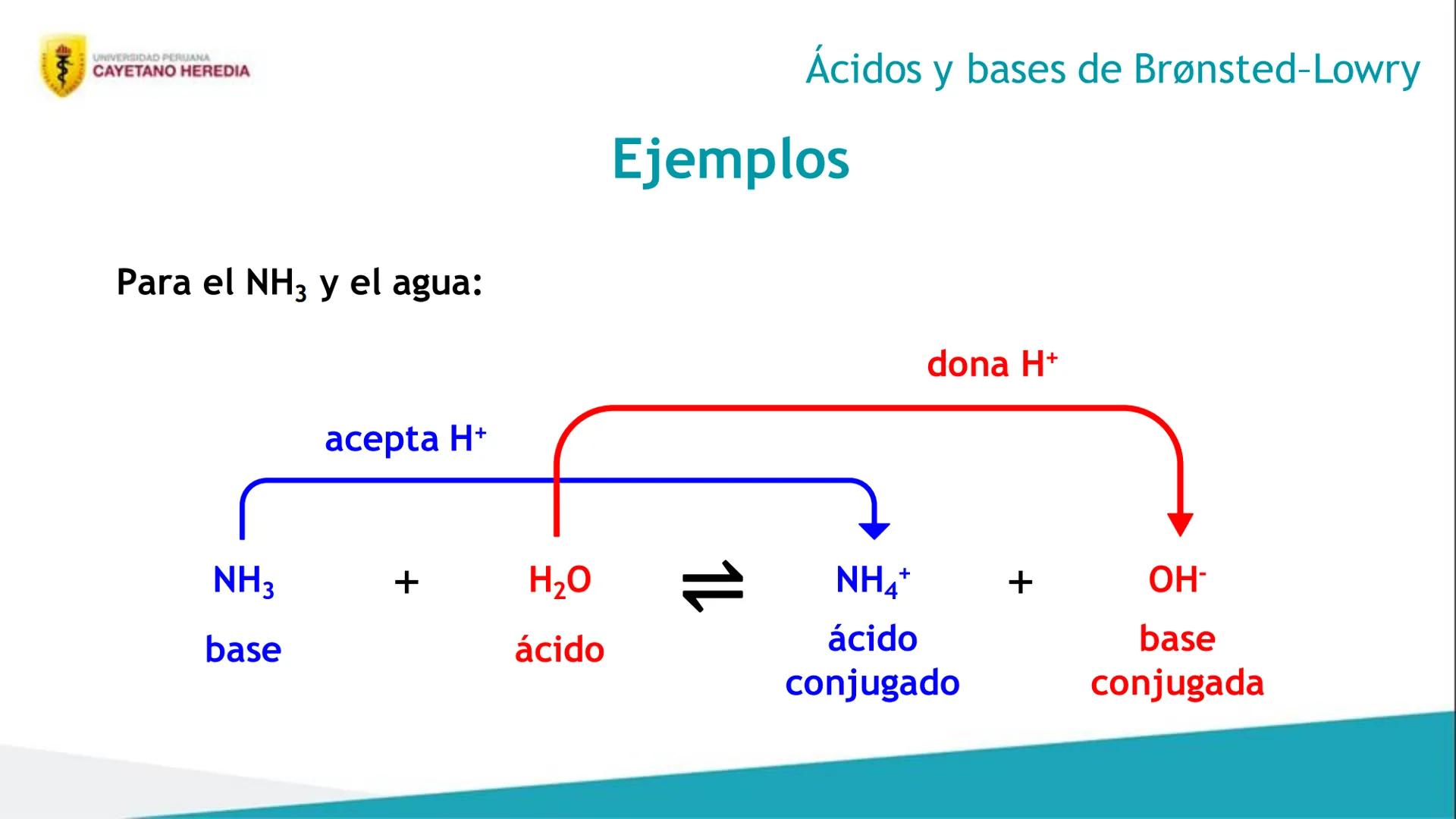
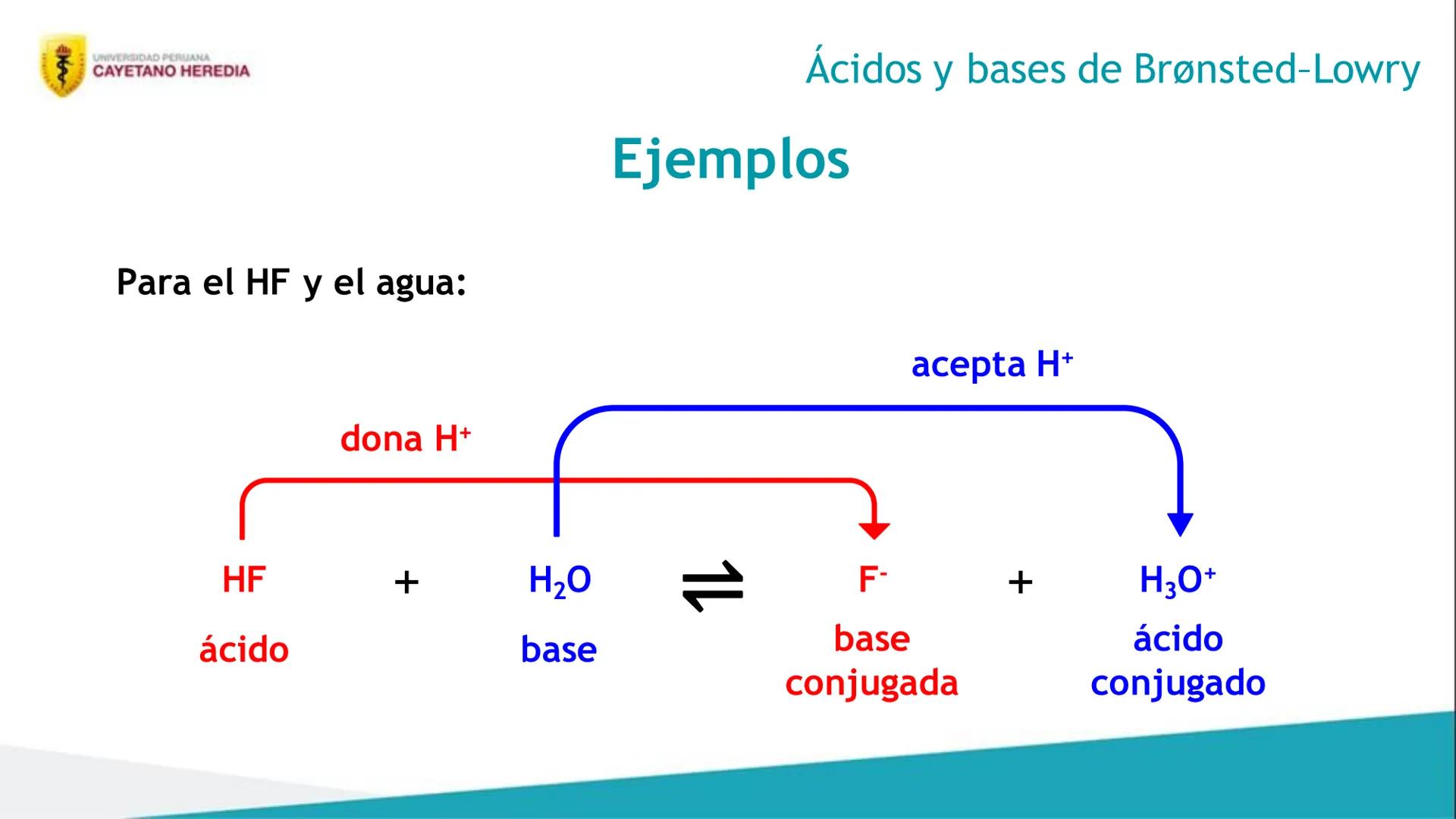
Después de estudiar este tema, vas a poder hacer cuatro cosas súper importantes para tus exámenes. Primero, distinguirás ácidos y bases usando las teorías de Arrhenius, Brønsted-Lowry y Lewis - cada una tiene su propia forma de explicar estos compuestos.
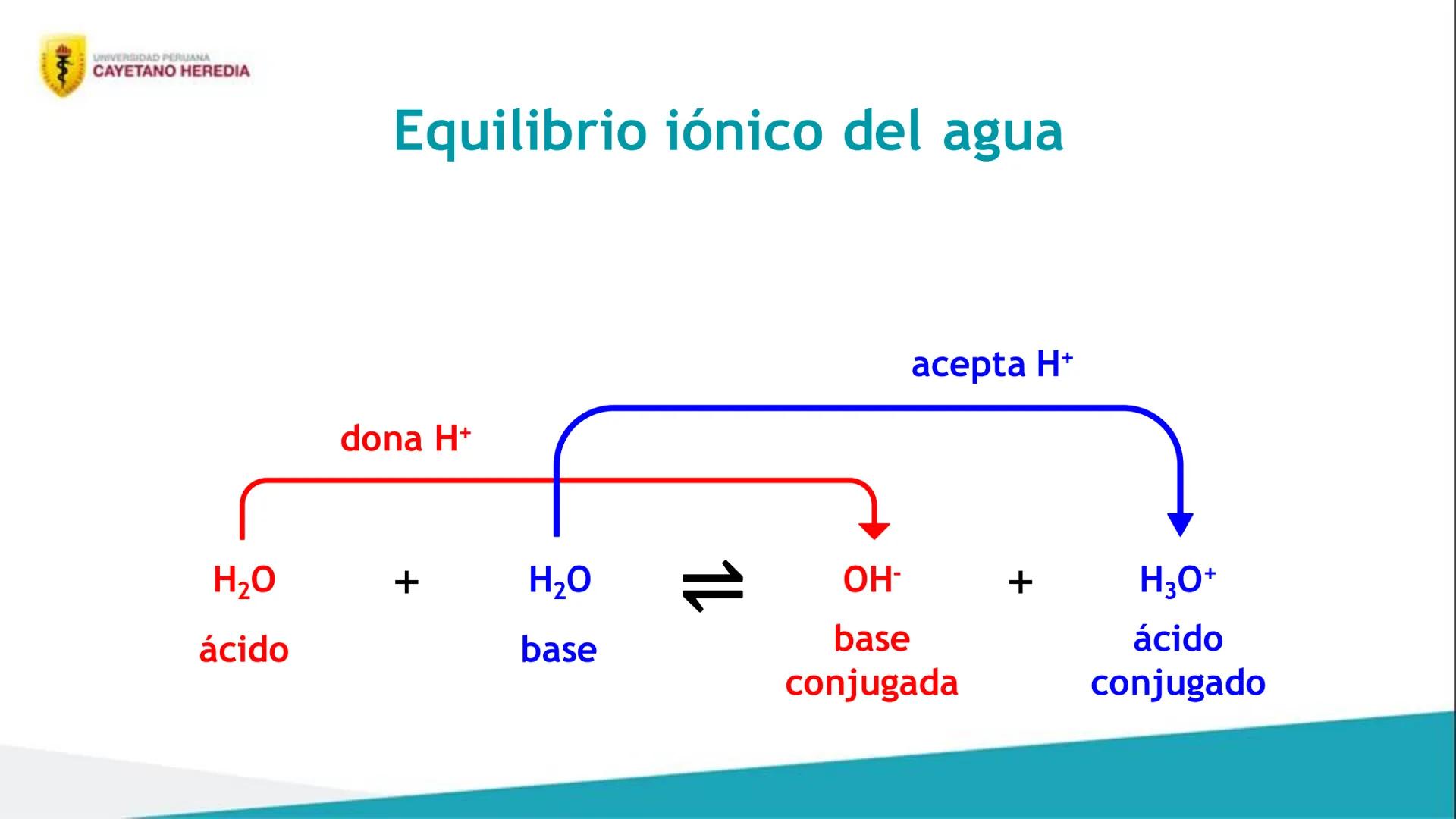
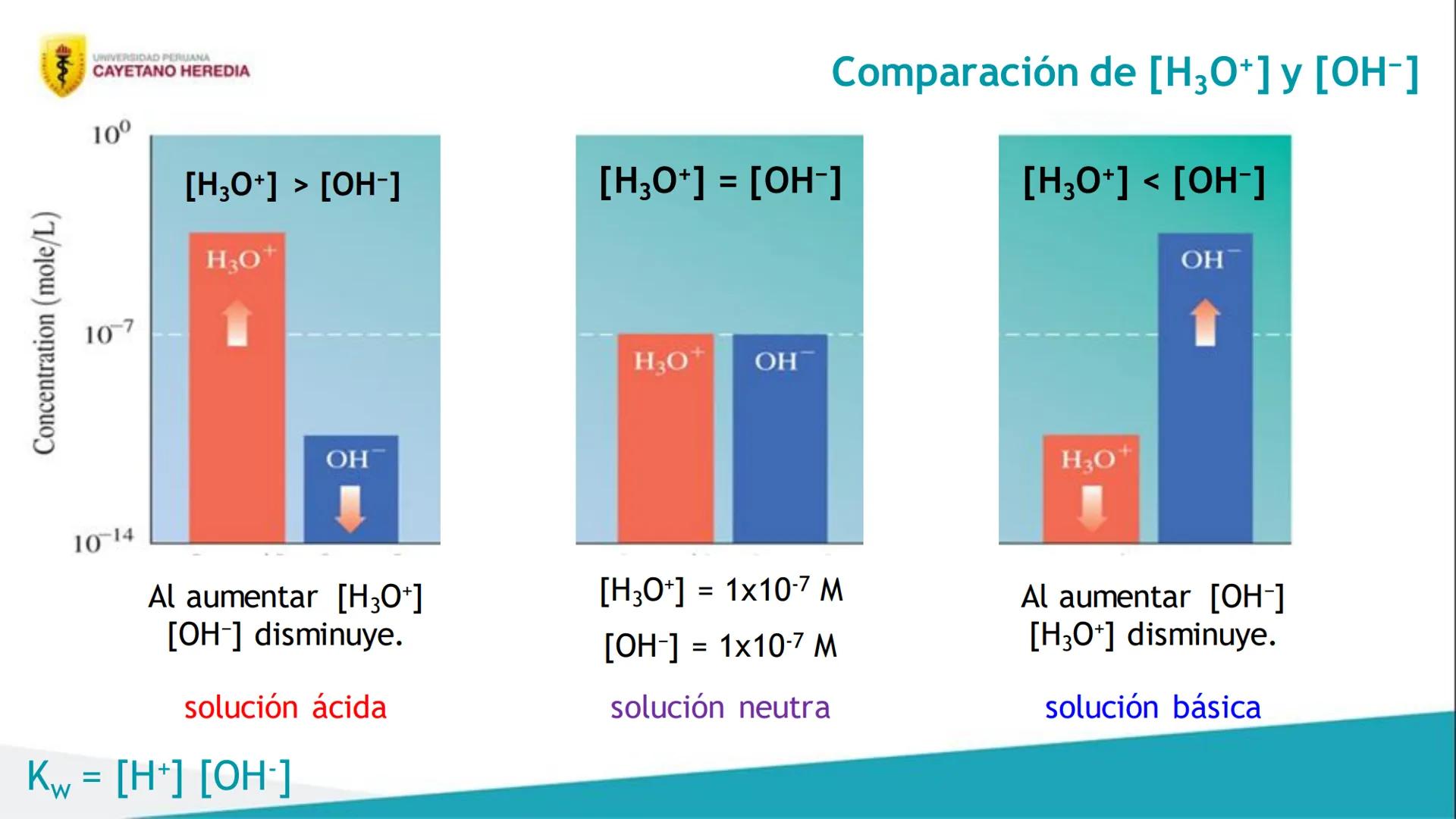
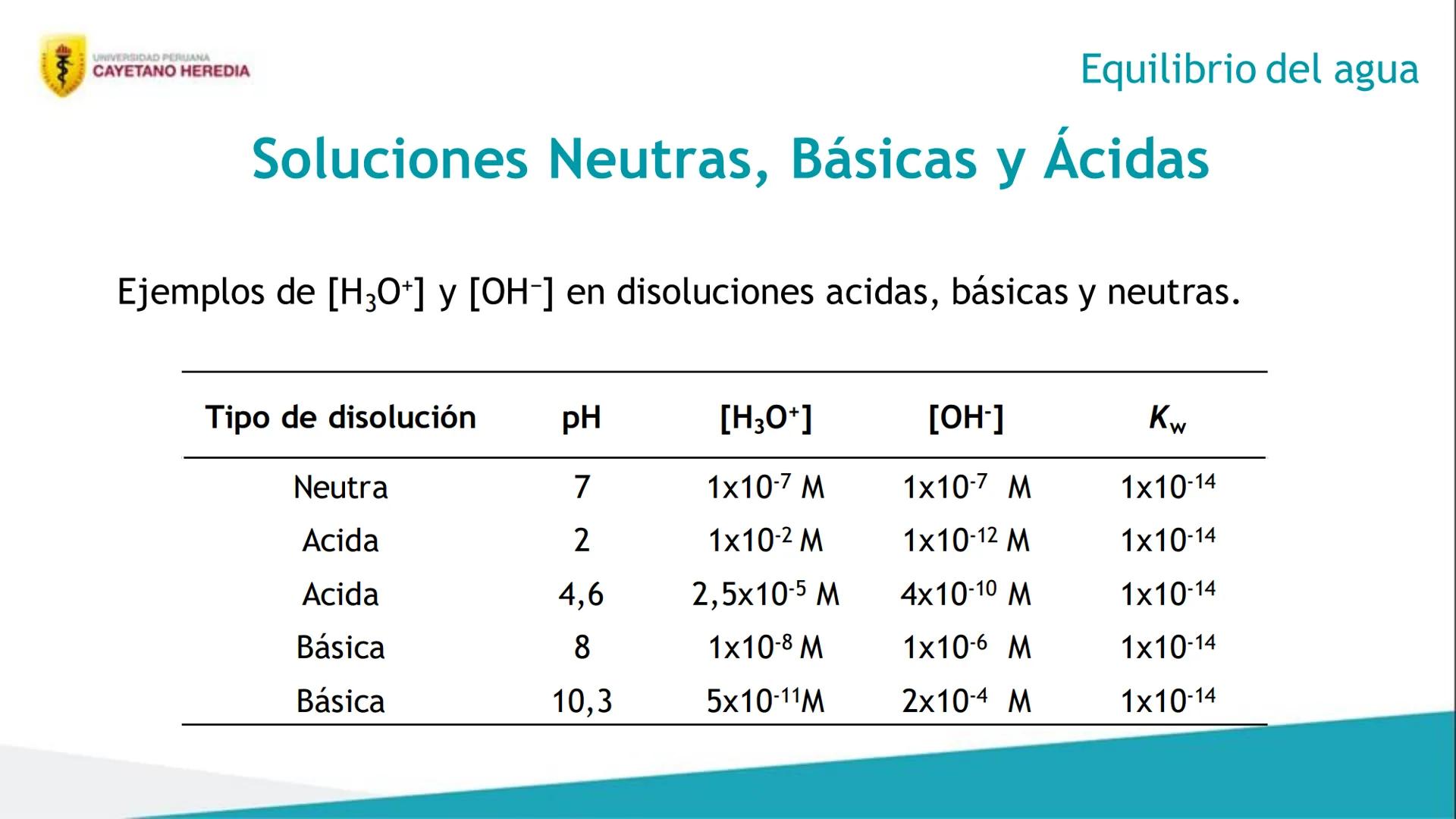
También vas a dominar el concepto de equilibrio iónico, que es clave para entender cómo se comportan las sustancias en agua. Aprenderás sobre el equilibrio del agua y su constante especial.
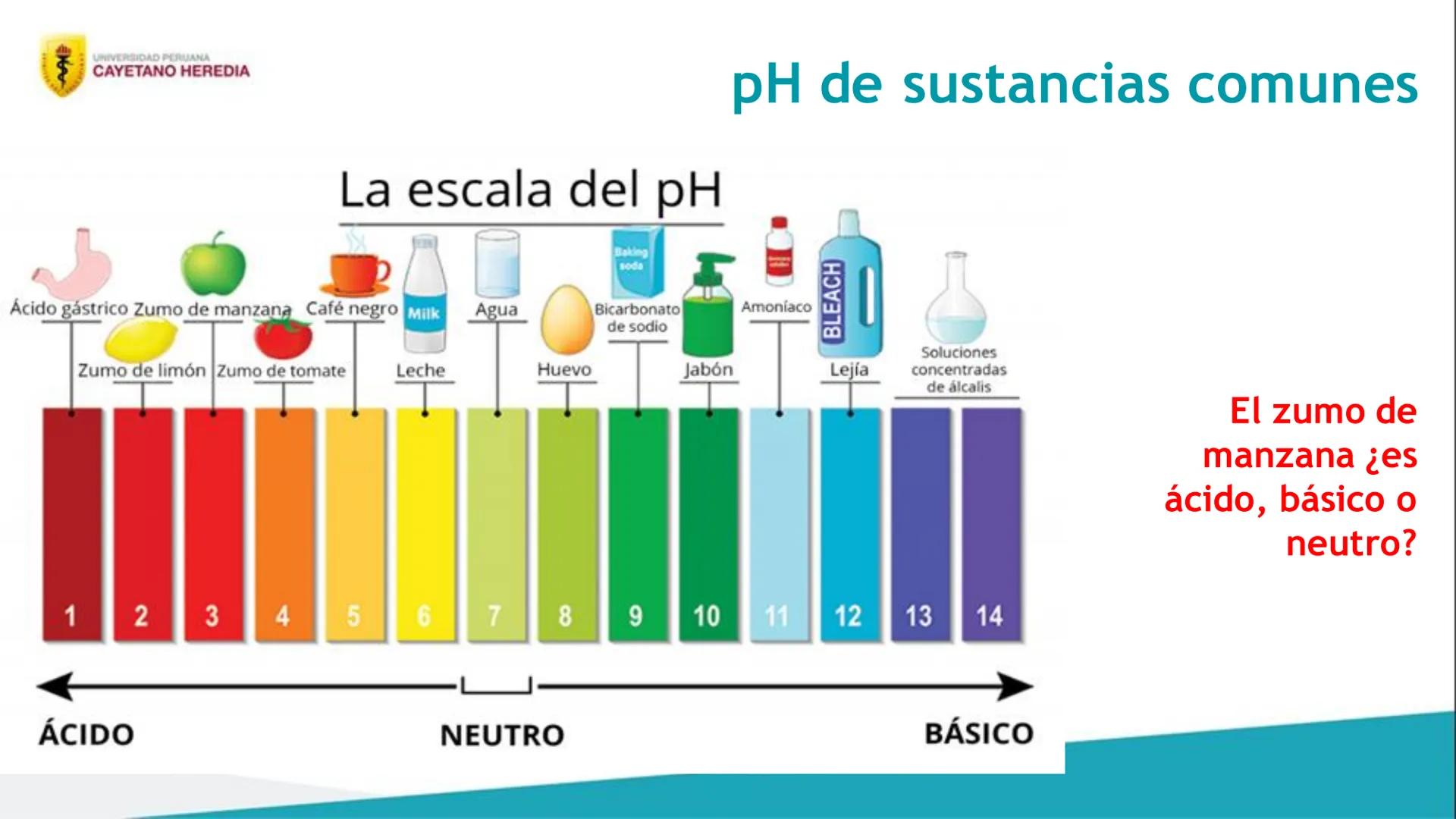
Finalmente, vas a conocer y explicar el pH, esa escala que siempre aparece en los exámenes y que te dice qué tan ácida o básica es una solución.
Consejo de estudio: Estas teorías se complementan entre sí, no se contradicen. Cada una amplía lo que sabemos sobre ácidos y bases.